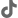Salud
Programa de Especialización en Farmacovigilancia y Tecnovigilancia
Realiza una adecuada evaluación y gestión clínica y de riesgos de reacciones e incidentes adversos relacionados con el uso de productos farmacéuticos y dispositivos médicos.
Inicio
Convocatoria 2026
Convocatoria 2026
Modalidad
Clases a distancia en tiempo real
Clases a distancia en tiempo real
Duración
128 horas lectivas
128 horas lectivas
Solicita más información
Acerca del programa
La farmacovigilancia y tecnovigilancia son actividades reguladas y obligatorias desde el proceso de fabricación hasta la distribución y el uso de los medicamentos y dispositivos médicos, respectivamente. Debido a su importancia en la protección de la salud pública, los profesionales involucrados en la cadena de suministro deben contar con una formación especializada en estas áreas. En este contexto, el Programa de Especialización en Farmacovigilancia y Tecnovigilancia de la EPG de la Universidad Continental brinda los conocimientos necesarios para un óptimo desempeño en el campo de la vigilancia sanitaria, abarcando aspectos históricos, regulatorios ―tanto nacionales como internacionales―, metodológicos y aplicativos en contextos asistenciales y empresariales.
El estudiante podrá aplicar estrategias para la identificación y recolección de sospechas de reacciones adversas por el uso de fármacos, evaluar la causalidad y gestionar el manejo clínico de las mismas en el marco de la normatividad vigente en farmacovigilancia y las buenas prácticas emitidas por la DIGEMID para la gestión de eventos adversos y otros problemas de seguridad. Además, conocerá los generalidades y características técnicas de los dispositivos médicos y estará en la capacidad de realizar acciones de seguridad en campo (ASC) y de preparar e interpretar informes periódicos de seguridad de estos equipos. Asimismo, desarrollará competencias para prevenir y gestionar los riesgos asociados a los productos cosméticos, con una visión estratégica y un enfoque en la investigación y la innovación.
Ventajas diferenciales
Perfil del estudiante
-
Químicos farmacéuticos, médicos, médicos veterinarios, enfermeras, obstetras y otros profesionales de la salud que formen parte de comités o equipos de farmacovigilancia y tecnovigilancia del ámbito asistencial, tanto en hospitales como en la autoridad reguladora local o nacional, o que se encuentren en formación para incorporarse a ellos.
-
Participantes de programas de gestión de riesgos o tecnovigilantes en laboratorios de productos farmacéuticos (de uso humano y veterinario), dispositivos médicos, cosméticos o droguerías que los comercialicen.
-
Profesionales de la salud dedicados al ámbito de la inspección, auditoría y aseguramiento de la calidad en uso de medicamentos y dispositivos médicos.
Certificación
Luego de aprobar todas las asignaturas del programa se te otorgará el certificado de especialista en Farmacovigilancia y Tecnovigilancia, a nombre de la Escuela de Posgrado de la Universidad Continental.
“Especialista en Farmacovigilancia y Tecnovigilancia”

(Imagen referencial que no representa la certificación que se obtendrá al culminar los estudios.)
Plana docente
*La programación de docentes por asignatura se encuentra sujeta a variación según su disponibilidad, asegurando el nivel equivalente del especialista. El perfil del docente se mantiene y corresponderá al nivel requerido para garantizar la calidad educativa.
Plan de estudios
El programa está organizado por 8 asignaturas, con un total de 128 horas lectivas:
- Historia de la farmacovigilancia.
- Manejo clínico de las reacciones adversas.
- Metodologías para evaluación de causalidad.
- Herramientas para medir y gestionar el riesgo.
- Farmacoepidemiología: conceptos y tipos de estudios.
- Evaluación de efectos de los medicamentos poscomercialización, RAM.
- Gestión de señales.
- Normatividad vigente en farmacovigilancia y tecnovigilancia.
- Regulación internacional latinoamericana y europea.
- Organización y cooperación internacional en farmacovigilancia y tecnovigilancia.
- Normativa peruana vigente de farmacovigilancia, sistema de aseguramiento de la calidad.
- Procedimientos operativos estandarizados, gestión de recursos y proveedores.
- Gestión de la información de seguridad (RAM, señales, IPS, PGR), gestión del archivo y manejo de auditorías e inspecciones.
- Generalidades de los dispositivos médicos.
- Características técnicas de los dispositivos.
- Introducción a la tecnovigilancia.
- Gestión y registro de la sospecha de incidentes adversos.
- Acciones de seguridad en campo.
- Informes periódicos de seguridad.
- Generalidades de gestión de riesgos.
- Estándares y guías internacionales.
- Seguimiento clínico poscomercialización.
- Generalidades de los cosméticos.
- Características técnicas de los cosméticos.
- Cosmetovigilancia: metodología y gestión de riesgos.
Malla curricular
Contacta con nuestro asesor

Victor Coz Vargas